Our Institute
Clinical Trials
Our Science
News
International Patients
- International Patients
- International patient Service Care
- Travel Arrangement and Hospital Admission
- FAQ
- Contact Us
基因治疗为肾上腺脑白质营养不良患者带来曙光
撰写:GIMI-王盈颖
ALD:罕见病背后的无声危机
肾上腺脑白质营养不良(Adrenoleukodystrophy,ALD)是一种罕见的X连锁隐性遗传病,男性患者居多。其发病机制源于ABCD1基因的突变。正常情况下,ABCD1广泛表达于脑内神经细胞、肾上腺皮质细胞以及外周血单核细胞等细胞中,对维持细胞内极长链脂肪酸(VLCFAs)的代谢平衡至关重要。
研究表明,不同细胞中ABCD1基因的表达存在显著差异。在肾上腺皮质细胞中,ABCD1的表达量较高,这与其高效代谢VLCFAs以维持正常肾上腺皮质激素合成密切相关。一旦ABCD1基因发生突变,其编码的蛋白功能异常,会导致VLCFAs在脑和肾上腺等器官中大量蓄积。这不仅会引发神经系统的进行性损害,表现为视力减退、听力下降、运动障碍、认知功能衰退等症状,还会导致肾上腺皮质功能减退,严重影响患者的生活质量和生存预后。尽管此类罕见病患者人数相对较少,但他们所面临的病痛和身心折磨不容忽视。
传统治疗的困境与局限
目前,针对ALD患者的传统治疗手段有限,主要以对症治疗为核心策略。例如,运用药物缓解神经系统症状,通过补充激素维持肾上腺功能等。但这些治疗方法仅能缓解症状,无法从根本上解决因基因缺陷导致的疾病问题。患者需要长期甚至终身依赖药物治疗,这不仅严重影响了生活质量,而且病情仍会逐渐恶化。长期药物治疗还可能引发一系列不良反应,如肝肾功能损害、免疫力下降等,进一步加重患者的身体负担和心理压力。
造血干细胞移植是一种相对前沿但已在临床应用的治疗方式,它通过将健康供体的造血干细胞移植到患者体内,重建患者的造血和免疫系统。临床研究显示,对于早期、病情较轻的ALD患者,造血干细胞移植可延缓部分患者神经系统损伤进展,少数情况下还能改善症状,但该方法面临诸多困境。首先,供体匹配难度大,成功率低;其次,移植风险高,患者需长期用免疫抑制剂防排斥,易增加感染等并发症;此外,移植费用高昂,限制了临床广泛应用。
基因治疗:开启治愈希望之门
基因治疗作为一种革命性的治疗策略,为ALD患者带来了前所未有的治愈希望。其核心原理是利用先进的生物技术手段,将正常的ABCD1基因导入患者体内,精准地替代或修复异常的ABCD1基因,从根源上纠正疾病的发生机制。深圳市免疫基因治疗研究院凭借在基因治疗领域深厚的转化应用技术积累和专业的科研团队,与合作医院积极投身于ALD基因治疗(NCT03727555、NCT03725670)。以下分享一些个案:
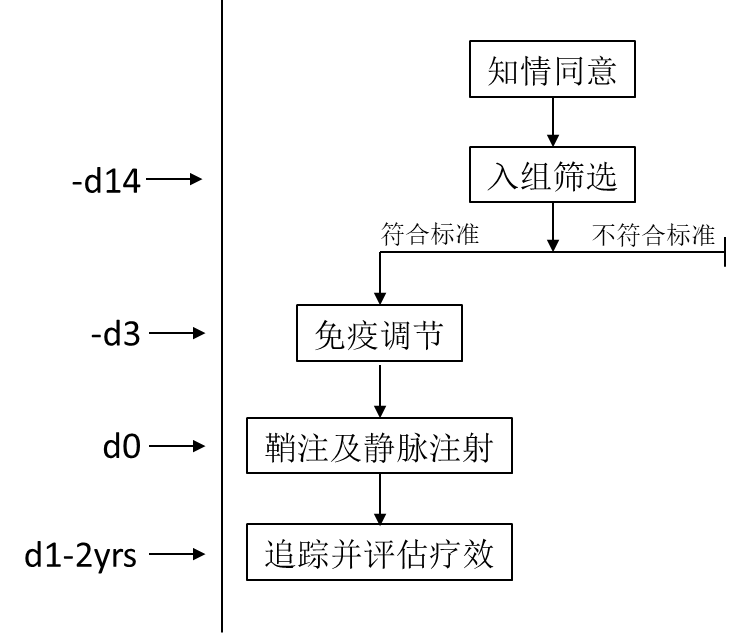
病例一:
患者基本信息:男,10岁时确诊ALD。ABCD1, Exon 1, C.521A>C (p. Tyr 174 Cys) 半合子突变。不具备干细胞移植资格。入组时患者14岁,ALD score I-II,NFS评分3。
基因治疗:甲强龙进行免疫抑制调节避免发生转基因排异。于Day 0腰穿鞘内注射ABCD1载体。随后继续使用甲强龙进行调节,剂量递减约1个月后停药。
疗效评估:MRI评估可见该患者接受基因治疗后,一年内疾病获得控制无进展。
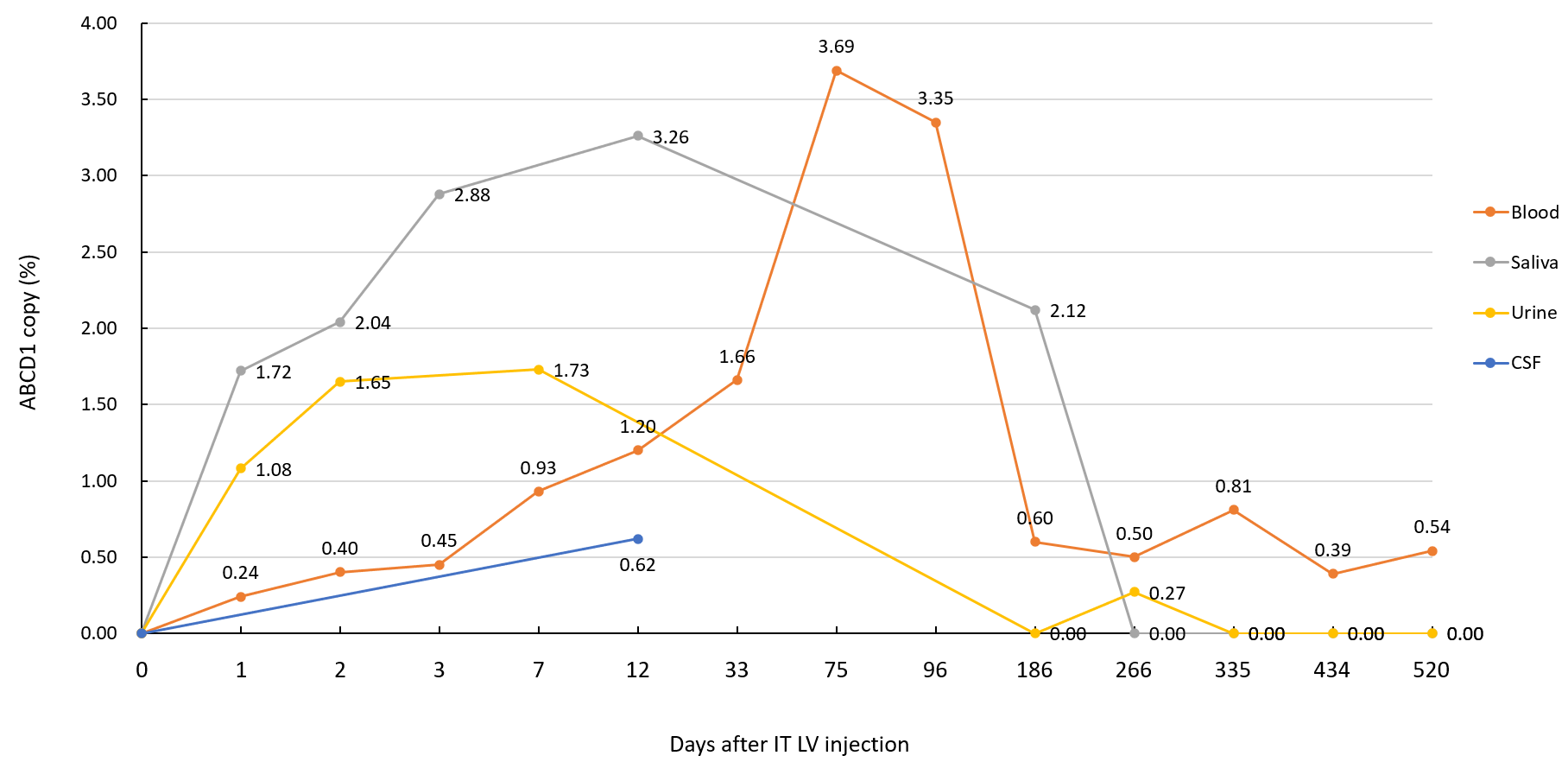
病例一 体内ABCD1载体的表达扩增情况
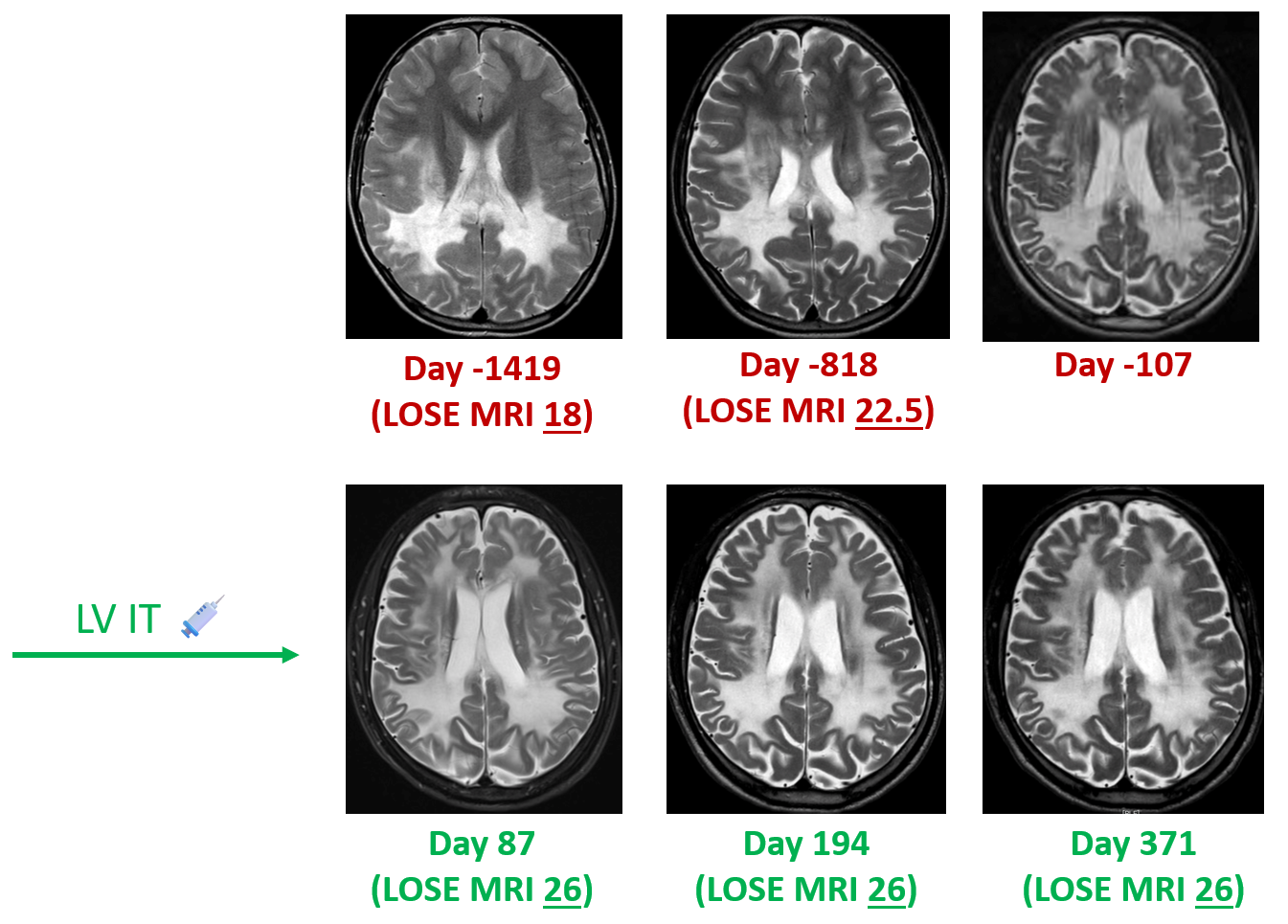
病例一 MRI及LOSE评分变化图
病例二:
患者基本信息:男,10岁时确诊ALD。ABCD1基因第2外显子存在新的半合子错义变异(c.956T>C,p.Leu319Pro)。不具备干细胞移植资格。入组时患者10岁,ALD score II,NFS评分4。存在协调能力受损,语言感知中断,嗜睡,并且行动困难等症状。
第一次基因治疗:甲强龙进行免疫抑制调节。于Day 0腰穿鞘内注射ABCD1载体。随后继续使用甲强龙进行调节,剂量递减约1个月后停药。
第二次基因治疗:甲强龙进行免疫抑制调节。于Day 171腰穿鞘内注射并联合静脉注射ABCD1载体。随后继续使用甲强龙进行调节,剂量递减约1个月后停药。
疗效评估:第一次治疗后Day 75 MRI评估与Day -47相比,疾病无进展。Day 155 MRI评估病理区存在模糊增大;患者行为上基本稳定,但出现视力障碍。第二次治疗后Day 268 MRI评估相对稳定。
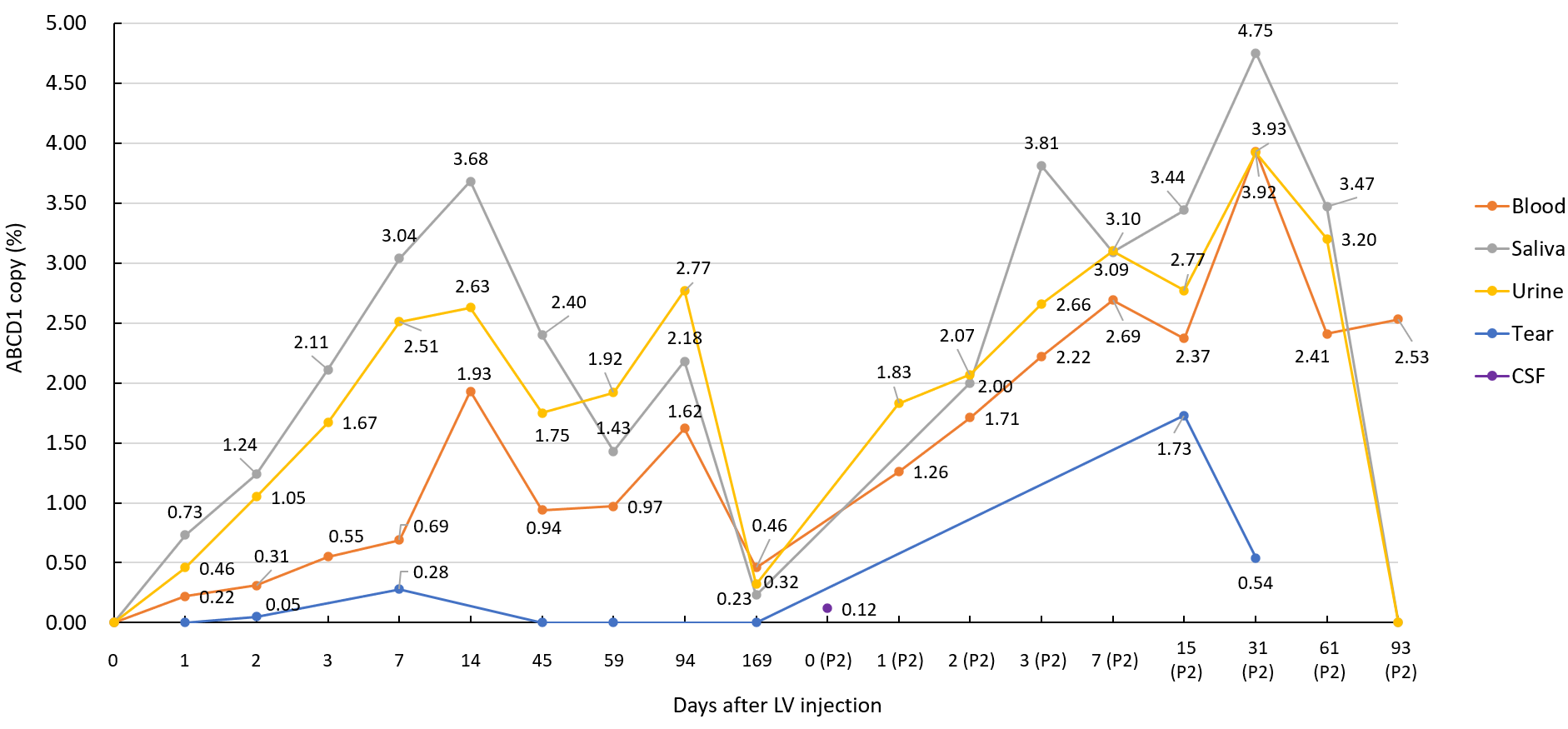
病例二 体内ABCD1载体的表达扩增情况
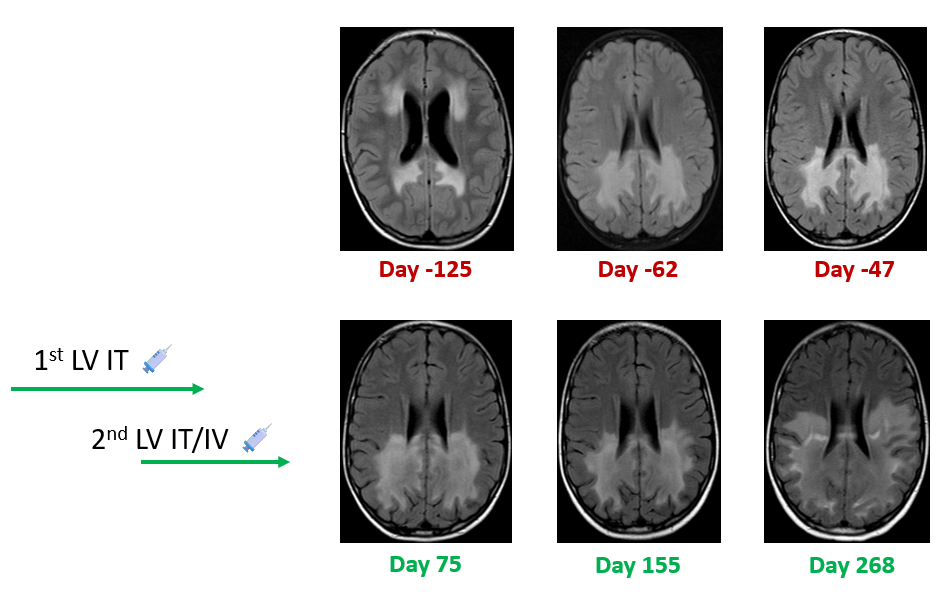
病例二 MRI变化图
结语:
GIMI研究院的针对ALD创新基因治疗在于采用了先进的基因载体技术和精准简单的注射流程,确保治疗的安全性和可行性。同时,我们还建立了完善的患者随访和评估体系,能够持续跟踪治疗效果,调整后续方案。目前,本项目已进入临床试验阶段,并且取得了阶段性的成果。我们坚信,随着技术的不断推进,将会有更多的ALD患者从中受益,重获健康生活。
参考文献:
1. Transcriptome analysis of ABCD1 gene expression in different cell types related to ALD.
2. Functional analysis of ABCD1 protein in neurons and its role in neurodegenerative mechanisms in ALD.
3. Intracerebral lentiviral ABCD1 gene therapy in an early disease onset ALD mouse model.
4. X连锁肾上腺脑白质营养不良症的基因治疗展望.
5. Phase I clinical trial of intracerebral injection of lentiviral-ABCD1 for the treatment of cerebral adrenoleukodystrophy.