文章转载自精准细胞治疗之家 药明康德
▎药明康德/报道
昨日,Kite Pharma公司公布了来自ZUMA-1临床试验的良好初步分析结果,其主要CAR-T候选药物axicabtagene ciloleucel(以前称作为KTE-C19)用于治疗在化疗耐受侵袭性B细胞非霍奇金淋巴瘤(NHL)患者。该研究达到了主要终点:单次输注axicabtagene ciloleucel后所记录的客观反应率(ORR)或肿瘤反应率(完全反应+部分反应)高达82%(p<0.0001)。
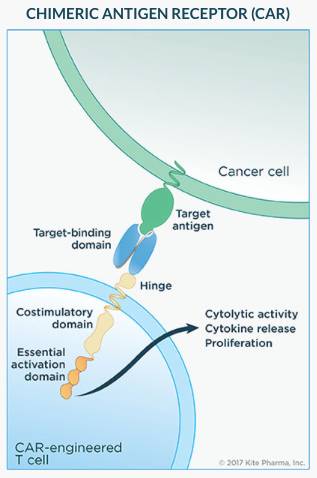
生物制药公司Kite致力于开发创新型肿瘤免疫疗法,旨在提供快速长期的持久反应,消除慢性护理的负担。该公司专注于嵌合抗原受体(CAR)和T细胞受体(TCR)工程化细胞疗法,目的是赋予免疫系统识别和杀死肿瘤的能力。Kite Pharma的主要产品候选物axicabtagene ciloleucel是一种在研CAR-T型新药疗法:患者的T细胞得以工程化表达嵌合抗原受体(CAR)靶向抗原CD19,所述抗原CD19是在B细胞淋巴瘤和白血病细胞表面上表达的蛋白质 ,有助于T细胞杀死癌细胞。美国FDA已经为axicabtagene ciloleucel颁发针对弥漫性大B细胞淋巴瘤(DLBCL)、转化滤泡淋巴瘤(TFL)和原发性纵隔B细胞淋巴瘤(PMBCL)的突破性疗法认定。
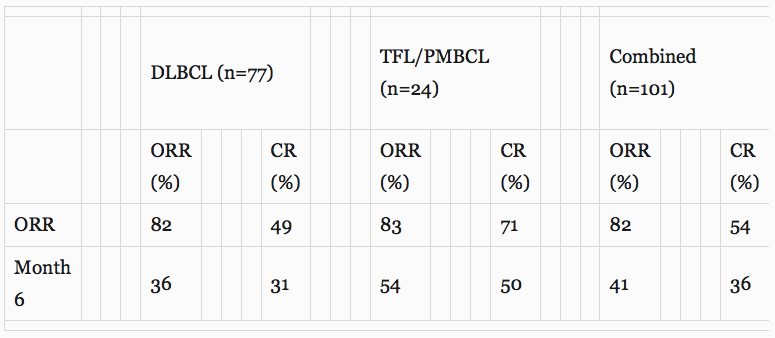
这些ZUMA-1结果证明了axicabtagene ciloleucel在具有多种类型的侵袭性NHL患者群体中的治疗效果,包括注册在队列1中的弥漫性大B细胞淋巴瘤(DLBCL)以及注册在队列2中的原发性纵隔B细胞淋巴瘤(PMBCL)和转化滤泡的淋巴瘤(TFL)。ZUMA-1临床试验治疗了100名患者。下表显示ORR和完全缓解(CR)率以及第6个月时的ORR和CR:
101名患者中有4名在数据截止之前没有第6个月的肿瘤评估,因此在上表中被归类为无反应者。这些患者在随访分析中有机会被计为第6个月的CR,这可能增加了反应度和CR率。
在第6个月,41%的治疗患者获得了反应,包括36%的CR。101例中的5例(5%)继续经历高度显著且持久的部分反应(PR),PET扫描只有最小异常。其中一个PR在第9个月时转换为CR。
中位随访8.7个月的初步分析,中位总生存期(OS)尚未达到。在类似的患者群体中,中位OS估计为6.6个月(SCHOLAR-1研究,ASCO 2016)。
▲Kite公司的研发管线(图片来源:Kite公司官网)
Kite计划根据所有101名患者的综合数据寻求axicabtagene ciloleucel在侵略性NHL适应症中的监管批准,并计划在2017年第一季度末完成生物制品许可证申请(BLA)的滚动提交。此外,Kite计划在2017年向欧洲药品管理局(EMA)提交axicabtagene ciloleucel的市场授权申请(MAA),用于治疗复发性或难治性DLBCL、PMBCL和TFL。来自初步分析的全部数据将于2017年4月在华盛顿特区召开的美国癌症研究协会(AACR)会议上得以公布。
▲Kite Pharma的临床发展高级副总裁Jeff Wiezorek博士(图片来源:Kite公司官网)
“这些axicabtagene ciloleucel结果非常好,并表明超过三分之一的难治性侵略性NHL患者通过单次输注axicabtagene ciloleucel后可被治愈。”Kite Pharma的临床发展高级副总裁Jeff Wiezorek博士说道。
参考资料:
[1] Kite Pharma (KITE)'s CAR-T Blood Cancer Candidate Succeeds in Major Study
[2] Kite Pharma官方网站